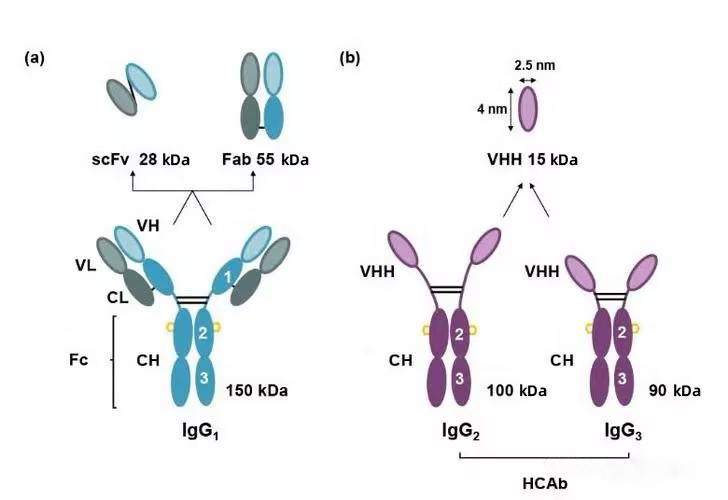
駝類(lèi)動(dòng)物體內含有3種不同亞型的抗體�����,分別是常規抗體IgG1�����、天然缺失輕鏈及CH1恒定域的重鏈抗體(heavy-chain antibody����,HCAb)IgG2和IgG3����。這種保留了全部抗原結合能力的天然無(wú)輕鏈及CH1區的單域抗體因其質(zhì)量?。s15 kDa�����,為IgG的十分之一)�����,也被稱(chēng)為納米抗體(nanobodies�,Nbs)或VHH抗體(variable domain of the heavy chain of heavy-chain antibody)�。與傳統抗體片段如抗原結合片段(fragment of antigen binding�����,Fab)和單鏈抗體(single chain antibody fragment����,scFv)相比��,納米抗體(nanobodies��,Nbs)具有多個(gè)明顯的優(yōu)勢��,比如免疫原性弱�、生產(chǎn)成本低��、水溶性好���、組織滲透性好�、穩定性與親和力較高等����。正是這些優(yōu)良特性使得納米抗體(nanobodies�����,Nbs)在生物技術(shù)方面得到了非常廣泛的應用���。
Structures and molecular mass of three different subtypes of antibodies and antibody fragments in camelid animals
對于大多數應用而言���,穩定性是制約抗體應用的關(guān)鍵因素之一��。一方面抗體在其生產(chǎn)��、運輸�����、儲存及使用的過(guò)程中容易發(fā)生多種物理和化學(xué)降解����,另一方面抗體的不穩定性聚集會(huì )潛在地影響產(chǎn)量����、保質(zhì)期和免疫原性等應用參數�。因此抗體的穩定性不僅會(huì )影響其生物學(xué)和生化評估�,還會(huì )影響純化��、儲存以及配方設計和生產(chǎn)���。在各種類(lèi)型的抗體中��,納米抗體(nanobodies�,Nbs)顯示出極好的溶解性�,并且對高溫和化學(xué)變性具有顯著(zhù)的抗性��,可以很大程度地克服傳統抗體片段scFv的聚集和降解等穩定性問(wèn)題��,是許多應用的理想選擇�����。
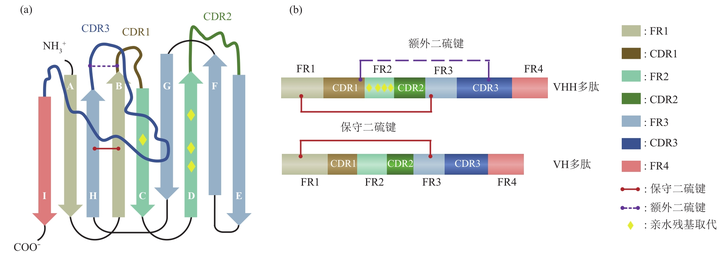
納米抗體(nanobodies�����,Nbs)與常規抗體可變區(variable region of heavy chain�,VH)的空間結構相似�����,其框架是由9個(gè)反向平行的β折疊片層(A-B-C-D-E-F-G-H-I)通過(guò)鏈間氫鍵和二硫鍵連接在一起組成����。在此結構中�����,3個(gè)CDR分別連接BC��、DE和HI鏈����,并靠N端形成連續表面�����,與抗原表位的表面互補����。連接CDR之間的氨基酸序列相對比較保守��,稱(chēng)為骨架區(framework region����,FR)�。幾乎所有納米抗體(nanobodies�����,Nbs)結構都含有一個(gè)連接FR1(C23)和FR3(C104)的保守二硫鍵��,該鍵跨越蛋白質(zhì)的內部�����,將兩個(gè)β鏈連接起來(lái)�����,增加了結構穩定性����。部分納米抗體(nanobodies����,Nbs)還含有一個(gè)可限制CDR環(huán)柔韌性和構象自由度的額外二硫鍵��。
傳統抗體VH和VL通過(guò)疏水作用力來(lái)穩定結構并共同構成抗原結合區�����。與之相比����,納米抗體(nanobodies����,Nbs)僅含有3個(gè)可變區��,盡管與抗原結合界面的表面積減少�����,但其仍具有較高的穩定性與親和力���。
它主要通過(guò)以下兩種方式來(lái)適應輕鏈的缺失:
一�、大量的親水性氨基酸取代先前與CH1�����、VL結合界面的脂肪族殘基(L12S���、V42F/Y���、G49E�����、L50R/C�、W52G/L)�,且部分FR2被拉伸扭轉的CDR3環(huán)覆蓋�����,避免與外界水環(huán)境的接觸�,從而防止納米抗體(nanobodies�,Nbs)的二聚化�����,其CDR3環(huán)越長(cháng)����,納米抗體(nanobodies���,Nbs)越穩定�����。另外還可在CDR3末端形成疏水核心�����,有利于穩定Nbs的折疊結構域�。
二���、納米抗體(nanobodies����,Nbs)的CDR1和CDR3普遍比VH的長(cháng)�,潛在地增加了互補位構象的多樣性��,從而以高度的形狀表面互補性與相應的抗原結合����,一定程度上彌補了輕鏈缺失造成的抗原結合力下降以及因尺寸小而導致的潛在序列多樣性降低���。
納米抗體(nanobodies����,Nbs)的小分子和單域屬性賦予了其比常規抗體更為穩定的特性�����,然而并非所有的納米抗體(nanobodies���,Nbs)都具有很好的熱穩定性與化學(xué)穩定性��。在以往研究的多個(gè)納米抗體(nanobodies���,Nbs)中�����,大約有2/3的納米抗體(nanobodies����,Nbs)在65℃處理后發(fā)生了不可逆的聚集�,但是部分納米抗體(nanobodies����,Nbs)在90℃高溫處理后仍具有90%的活性�。這些穩定性差異的根本原因在于納米抗體(nanobodies��,Nbs)特殊結構的差異�,包括氨基酸序列���、二硫鍵的數量與位置���、結構域的構象等���。
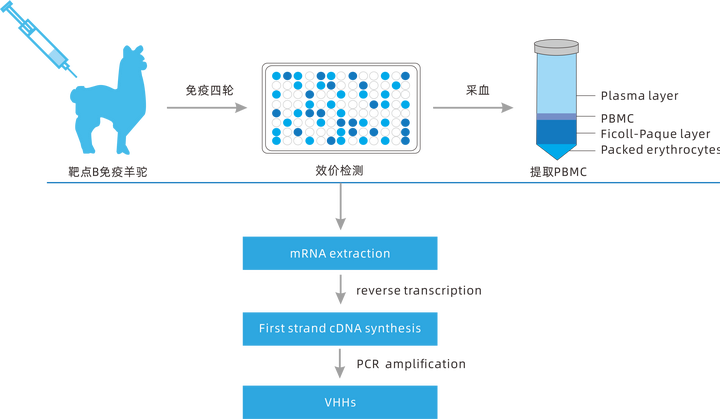
那么�����,如何構建穩定性更高����、親和力更強的納米抗體(nanobodies����,Nbs)呢����?普健生物深耕蛋白抗體領(lǐng)域15余年����,在高質(zhì)量納米抗體(nanobodies�,Nbs)制備技術(shù)上擁有自主核心技術(shù)��,與知名科研單位���、研究院所���、醫藥研發(fā)企業(yè)成功合作相關(guān)項目20000+����。在納米抗體的制備方面��,動(dòng)物的選擇是免疫成功的關(guān)鍵�����,普健生物自建養殖基地����,每年近百頭成年羊駝?dòng)糜诿庖?����,穩定提供大量的免疫抗原�。通過(guò)設計目標抗原對健康強壯���、精神良好����、體型適中的羊駝進(jìn)行四輪免疫后進(jìn)行效價(jià)檢測����,當血清免疫效價(jià)達到預期后���,再提取總RNA用于噬菌體文庫的構建�����,利用噬菌體展示技術(shù)進(jìn)行篩選得到高特異性和強親和力的納米抗體�。
此外�,普健生物還可根據科研需求��,在分子設計時(shí)選擇性加入功能區或基于納米抗體(nanobodies��,Nbs)結構特征采用合理的設計方法進(jìn)行結構穩定性?xún)?yōu)化��,例如共有序列驅動(dòng)的序列修復����、替換易于修飾的氨基酸�����、非天然二硫鍵的引入和CDR的移植����。通過(guò)這些策略開(kāi)發(fā)出在極端條件下仍能保持結合能力的穩定Nbs����,從而為生物技術(shù)���、檢測�����、診斷和治療應用提供高性能的試劑����。
選擇普健生物納米抗體(nanobodies����,Nbs)的優(yōu)勢
普健生物可以提供針對特定靶點(diǎn)的特異性納米抗體定制服務(wù)����,包括抗原檢測��,羊駝免疫���,采血��,效價(jià)檢測��,納米抗體噬菌體庫構建及淘選���,特異性高親和力納米抗體篩選���,表達����,檢測一條龍服務(wù)��。親和力可以達到108~1010M級別���。
自建養殖基地:每年近百頭成年羊駝?dòng)糜诿庖?����,穩定提供大量的免疫抗原
淘選周期短:最快在2周內可完成針對各類(lèi)靶點(diǎn)的特異性納米抗體快速篩選
樣本來(lái)源豐富:免疫庫源自百余只不同種類(lèi)的駝類(lèi)樣本-羊駝(Alpaca )����、駱駝(Camel)�����、美洲駝(Llama)����,提供更高抗體多樣性
超高品質(zhì):插入正確率100%��,序列正確率97%����,隨機選取200個(gè)克隆測序�����,均無(wú)重復序列
[1]Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains. Nature, 1993, 363(6428): 446-448
[2]Li C, Tang Z, Hu Z, et al. Natural single-domain antibody-nanobody: a novel concept in the antibody field. J Biomed Nanotechnol, 2018, 14(1): 1-19
[3]Steeland S, Vandenbroucke R E, Libert C. Nanobodies as therapeutics: big opportunities for small antibodies. Drug Discov Today, 2016, 21(7): 1076-1113
[4]He T, Zhu J, Nie Y, et al. Nanobody technology for mycotoxin detection in the field of food safety: current status and prospects. Toxins, 2018, 10(5): 180
[5]Hoey R J, Eom H, Horn J R. Structure and development of single domain antibodies as modules for therapeutics and diagnostics. Exp Biol Med, 2019, 244(17): 1568-1576
[6]Liu M, Li L, Jin D, et al. Nanobody–a versatile tool for cancer diagnosis and therapeutics. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2021, 13(4): e1697
[7]Kunz P, Zinner K, Mücke N, et al. The structural basis of nanobody unfolding reversibility and thermoresistance. Sci Rep, 2018, 8(1): 7934
[8]Akazawa-Ogawa Y, Takashima M, Lee Y H, et al. Heat-induced irreversible denaturation of the camelid single domain VHH antibody is governed by chemical modifications. J Biol Chem, 2014, 289(22): 15666-15679
[9]Hagihara Y, Mine S, Uegaki K. Stabilization of an immunoglobulin fold domain by an engineered disulfide bond at the buried hydrophobic region. J Biol Chem, 2007, 282(50): 36489-36495
[10]Turner K B, Liu J L, Zabetakis D, et al. Improving the biophysical properties of anti-ricin single-domain antibodies. Biotechnol Rep, 2015, 6: 27-35
[11]Zabetakis D, Olson M A, Anderson G P, et al. Evaluation of disulfide bond position to enhance the thermal stability of a highly stable single domain antibody. PLoS One, 2014, 9(12): e115405
[12]Melarkode V A, Shinada N K, Narwani T J, et al. Discrete analysis of camelid variable domains: sequences, structures, and in-silico structure prediction. PeerJ, 2020, 8: e8408
[13]Lefranc M P, Lefranc G. IMGT® and 30 years of immunoinformatics insight in antibody V and C domain structure and function. Antibodies, 2019, 8(2): 29
[14]Govaert J, Pellis M, Deschacht N, et al. Dual beneficial effect of interloop disulfide bond for single domain antibody fragments. J Biol Chem, 2012, 287(3): 1970-1979
[15]Vincke C, Muyldermans S. Introduction to heavy chain antibodies and derived nanobodies. Methods Mol Biol, 2012, 911: 15-26
[16]Kunz P, Ortale A, Mücke N, et al. Nanobody stability engineering by employing the Delta ΔTm shift; a comparison with apparent rate constants of heat-induced aggregation. Protein Eng Des Sel, 2019, 32(5): 241-249
[17]Mendoza M N, Jian M, King M T, et al. Role of a noncanonical disulfide bond in the stability, affinity, and flexibility of a VHH specific for the Listeria virulence factor InlB. Protein Sci, 2020, 29(4): 1004-1017